01. 从传统治疗到精准治疗的跨越

近年来,诺华的Lutathera®和Pluvicto®等药物的成功获批,大大加速了核药的发展。诺华2024年的财报显示Pluvicto®作为其中的重磅产品之一,2024年收入达到13.92亿美元,同比增长42%,这是该药自2022年上市以来,销售额首次突破10亿美元大关。与此同时,Lutathera®也表现不俗,2024年销售额达到7.24亿美元,同比增长20%。两款核药在2024年总收入达到21.16亿美元,这一成绩不仅展现了放射性配体治疗诊断学在市场上的巨大潜力,更激发了全球科研者对新型放射性核素、靶向策略以及临床应用的深入探索。在癌症治疗领域,放射性配体的诊断和治疗学(Radioligand Theranostics)正以其独特的精准性和创新性,引领着肿瘤治疗的变革,它巧妙地将诊断成像与靶向放射性核素治疗相结合,实现了从传统“一刀切”式治疗到精准狙击肿瘤细胞的跨越。
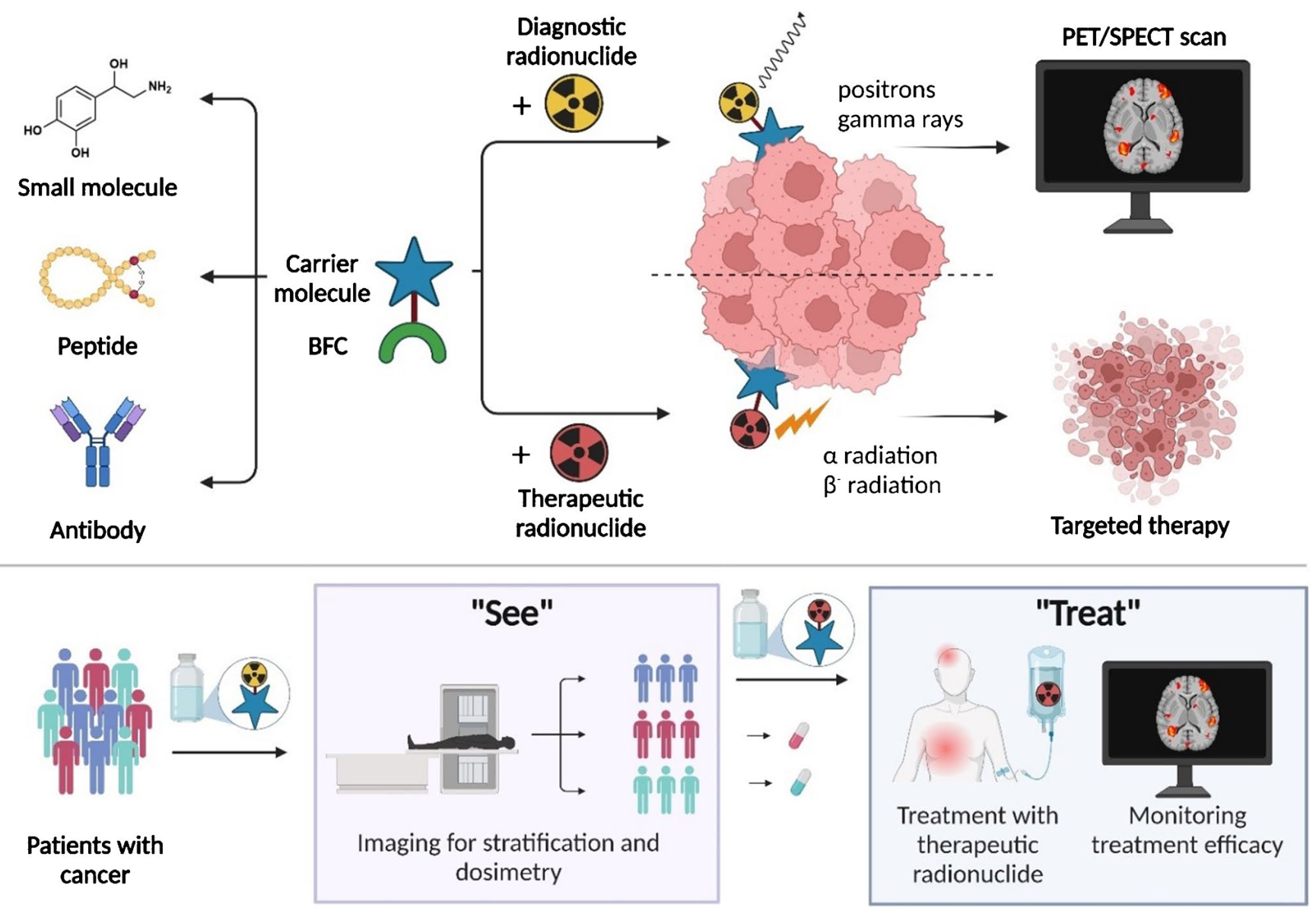
2025年2月1日,MD安德森癌症中心的H. Charles Manning教授为通讯作者于核医学期刊《European Journal of Nuclear Medicine and Molecular Imaging》发表题为“Radiotheranostic landscape: A review of clinical and preclinical development”的综述论文,深入剖析了核药在临床和临床前研究中的最新进展,探讨了这一领域在精准肿瘤治疗中的巨大潜力以及面临的挑战。研究者不仅对截至2024年12月的全球活跃临床试验数据进行了系统梳理(数据来源:ClinicalTrials.gov和TheranosticTrials.org),还深入挖掘了近期的学术文献,重点关注放射性核素生产、靶向分子和放射化学等领域的创新成果。小核仅做粗浅解读,感兴趣的读者可以检索原文仔细拜读,深入了解核药前沿领域的最新动态。

本综述的通讯作者H. Charles Manning博士是德克萨斯大学MD安德森癌症中心的教授,同时也是癌症研究的CPRIT学者。他在2020年9月加入MD安德森癌症中心,担任先进生物医学成像中心(CABI)的科学主任、回旋加速器放射化学设施(CRF)的主任,并共同领导Theranostics类的项目,其研究主要集中在用于癌症的诊断和治疗的新型放射性药物的发现、转化和生物学验证。
02. 创新驱动核药的蓬勃发展
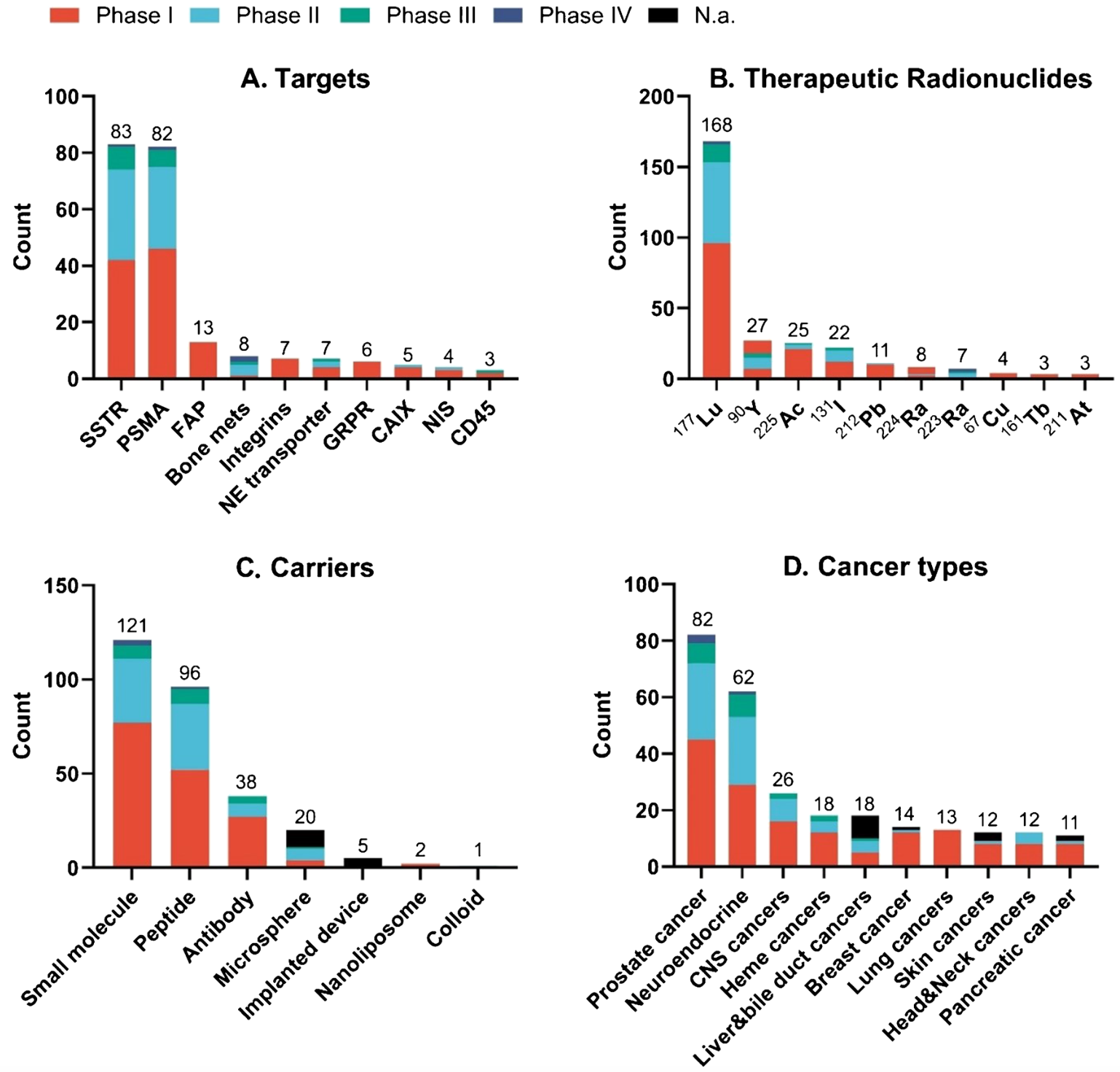
本图展示了截至2024年12月正在进行的临床试验中,靶向放射治疗药物的评估情况。图中包括了临床试验中涉及的前十大靶点(A)、治疗性放射性核素(B)、核药涉及载体类型(C)以及前十大癌症类型(D)。图中显示,SSTR和PSMA仍然是最热门的靶点;镥-177是最常用的治疗性放射性核素。
在临床研究方面,靶向生长抑素受体(SSTR)和前列腺特异性膜抗原(PSMA)的药物一直是放射治疗诊断学领域的“明星产品”。这些药物凭借其明确的靶点和显著的疗效,在治疗神经内分泌肿瘤和前列腺癌等疾病中发挥了重要作用。然而,随着研究的不断深入,越来越多的新靶点逐渐进入科研人员的视野。成纤维细胞激活蛋白(FAP)、整合素和胃泌素释放肽受体(GRPR)等新靶点在临床和临床前研究中展现出巨大的潜力。这些新靶点的发现,不仅为放射治疗诊断学的应用拓展了新的领域,也为那些传统治疗手段无效的癌症患者带来了新的希望。
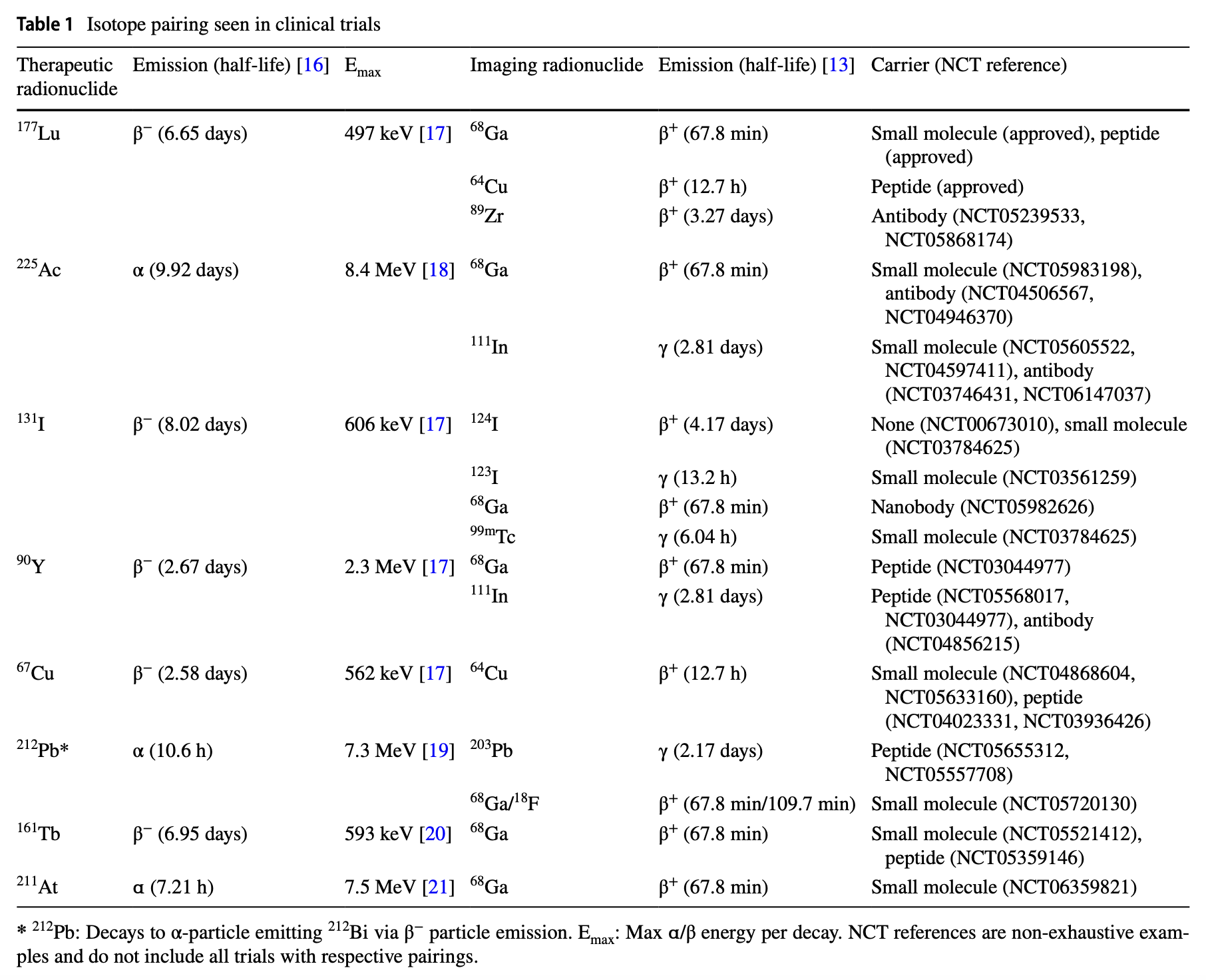
表1列出了在临床试验中使用的核素诊疗对情况,详细列出了治疗核素及其主要衰变模式、最大能量、用于成像的核素以及相关的临床试验编号。
在放射性核素载体方面,小分子和肽类一直是较为主流选择。它们具有良好的生物相容性和易于合成的特点,能够高效地将放射性核素输送到肿瘤组织。然而,随着对肿瘤生物学的深入了解,基于抗体的载体也逐渐崭露头角:双特异性抗体、免疫球蛋白衍生的抗原结合片段和抗体模拟蛋白等新型载体,凭借其高度的特异性和适应性,能够精准地识别肿瘤细胞表面的靶点,从而提高治疗的精准度和效果。此外,放射性配体设计的创新也为放射治疗诊断学的发展注入了新的活力,从激动剂到拮抗剂的转变,以及具有增强药代动力学和肿瘤靶向特性的修饰肽的开发,进一步优化了放射性药物的性能。
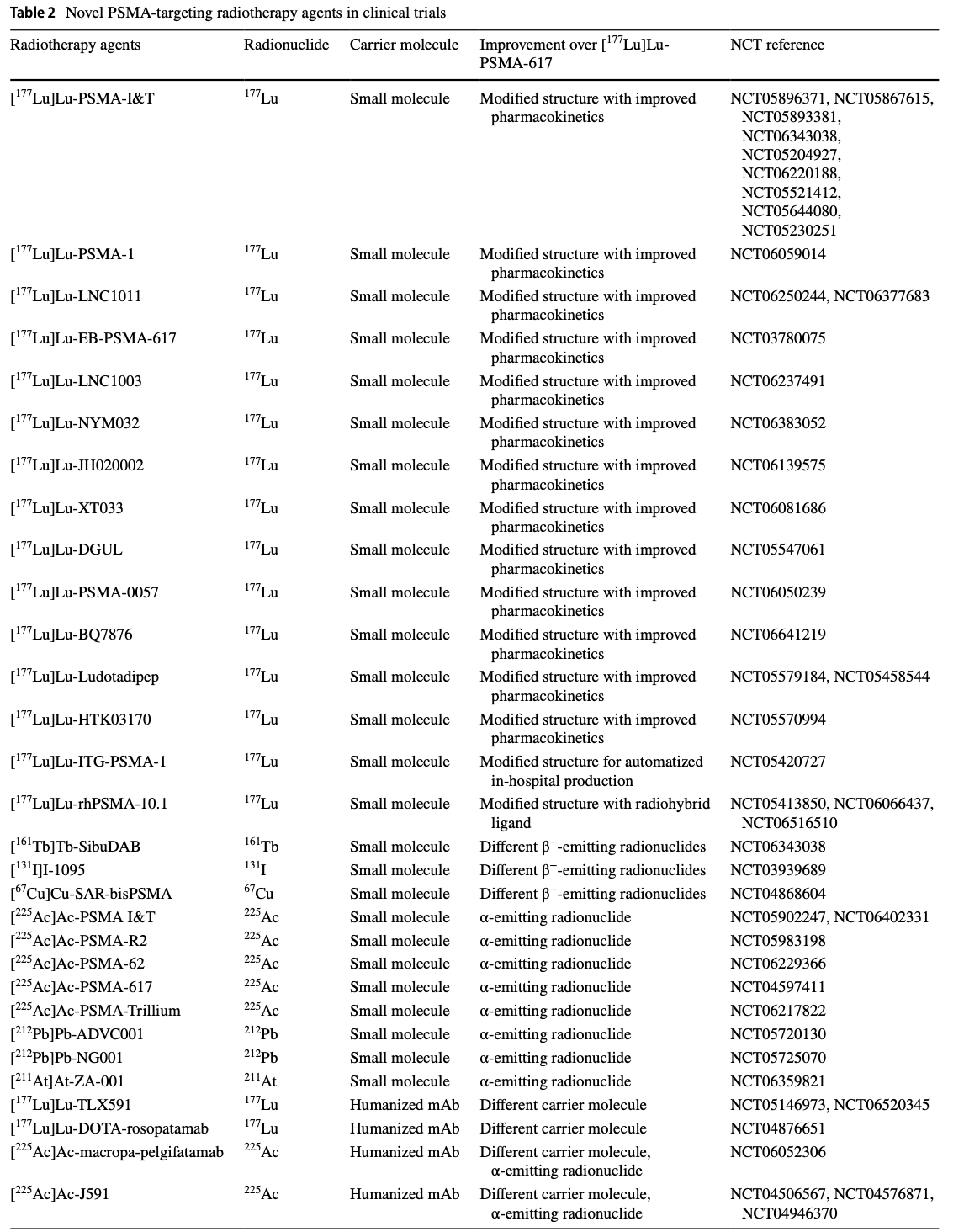
表2列出了新一代前列腺特异性膜抗原(PSMA)靶向放射治疗药物的详细信息。表格中包括了药物名称、放射性核素、载体分子、与[177Lu]Lu-PSMA-617相比的改进之处,以及相关的临床试验编号(NCT)。这些新药物通过改进结构、使用不同的放射性核素或载体分子,旨在提高药物的药代动力学特性、肿瘤靶向能力和治疗效果。
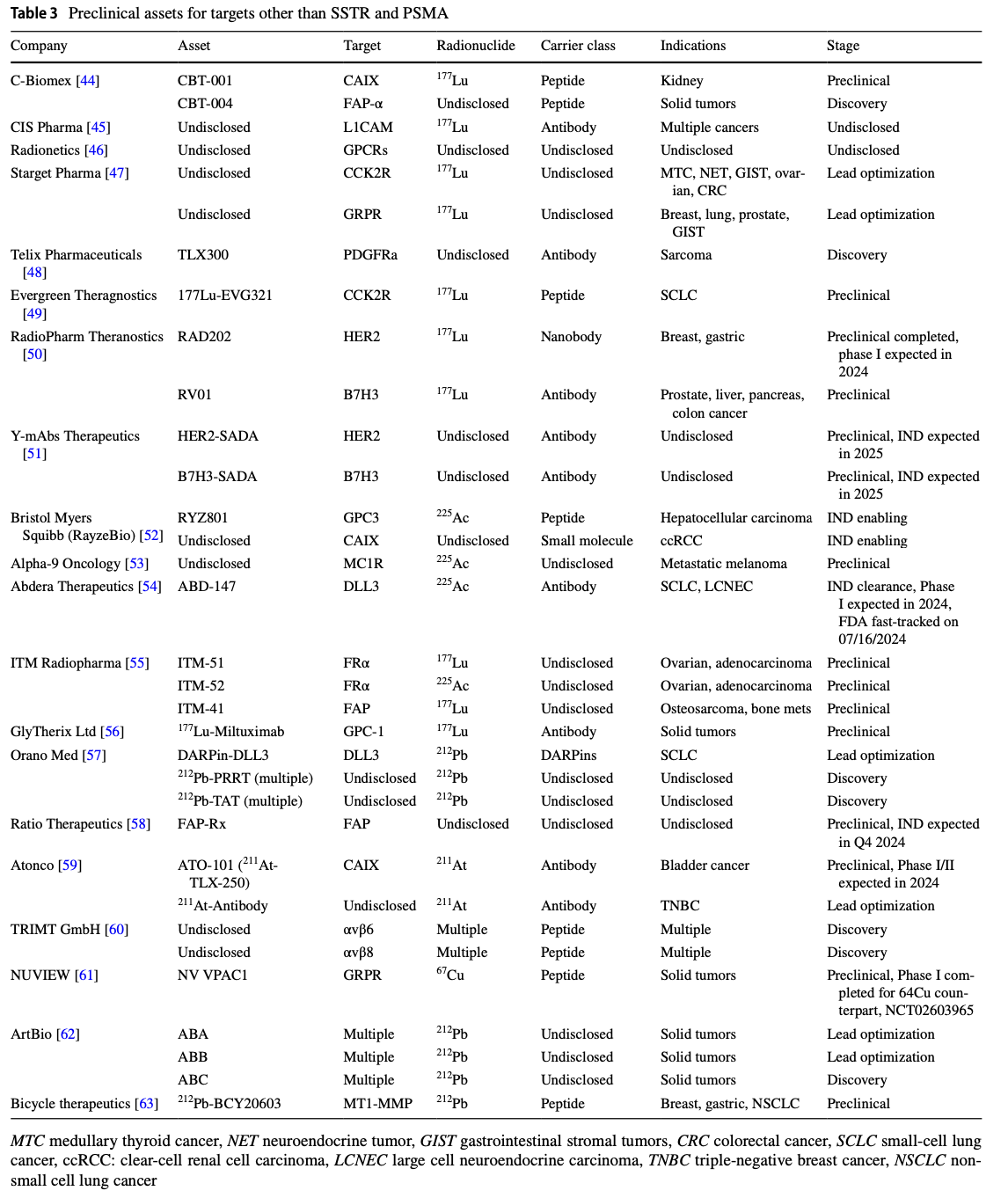
表3列出了目前处于临床前研究阶段的、非SSTR和PSMA靶点的放射治疗药物。表格中包括了公司名称、药物名称、靶点、放射性核素、载体类别、适应症以及研发阶段。这些药物涵盖了多种新的靶点,如CAIX、FAP、GRPR等,展示了放射治疗诊断学在不同癌症类型中的潜在应用。

本图展示了当前和新一代核药的结构示例。
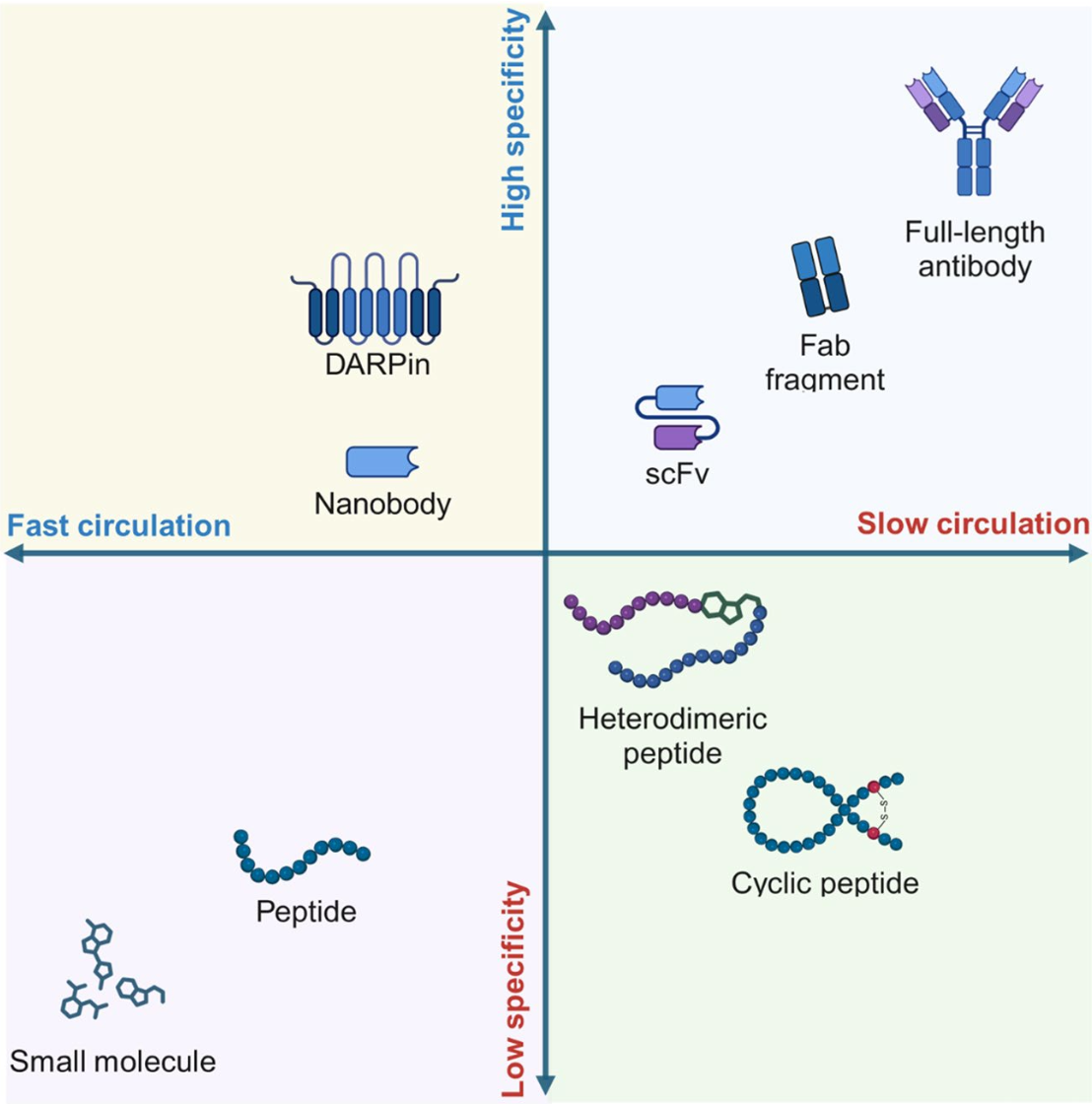
本图总结了不同放射性核素载体(如抗体、抗体片段、小分子和肽类)的优势和劣势。抗体具有高特异性和长循环时间,但可能导致较高的非靶毒性;而小分子和肽类则具有更好的组织穿透性和细胞内化效率,但亲和力较低且循环时间相对较短。
新一代治疗性放射性核素的研究令人瞩目,铽-161、锕-225、铅-212等新型放射性核素,正在被积极探索以补充或替代传统的镥-177。这些新型放射性核素具有更高的能量和更优的物理特性,有望在提高疗效的同时,进一步降低对正常组织的毒性。此外,配对的放射性核素和放射性杂化体系的出现,也为核药的设计提供了更多的灵活性。配对核素能够实现成像和治疗的完美结合,优化治疗剂量学,而放射性杂化体系则能够在单个分子内螯合化学性质不同的放射性核素对,进一步拓展了放射治疗诊断学的应用范围。
03. 机遇与挑战并存
尽管核药正在以前所未有的速度革新精准医疗版图,但要实现其全面临床应用,仍需解决诸多“卡脖子”难题。首先,放射性核素供应链瓶颈问题较为突出。由于放射性核素的半衰期较短,其规模化生产不仅需要高度专业化的设备和技术,还需构建涵盖生产、纯化和质控的全链条技术体系。目前全球范围内放射性核素的生产能力有限,难以满足日益增长的临床需求,供需矛盾持续加剧。其次,监管体系滞后于技术创新,现有的监管政策和技术标准尚不完善,这在一定程度上限制了核药临床应用的推广,也是亟待解决的问题之一。此外,多学科交叉型人才储备不足。核药涉及核医学、肿瘤学、放射化学和药学等多个学科领域,需要具备跨学科知识的专业人才来推动其发展。然而目前全球范围内相关专业人才的培养体系尚不健全,人才短缺问题也较为突出。
在这一充满机遇与挑战的时代,学术界、工业界和监管机构之间的协作或许比以往任何时候都更为重要。产学研医管多方协同破局,可能会是释放核药真正潜力的关键所在,只有携手共进,才能加速创新,优化临床结果,让核药尽早惠及患者。